Pengertian Termodinamika adalah ilmu yang menggambarkan/menjelaskan mengenai usaha mengubah kalor (yakni perpindahan energi yang disebabkan karna perbedaan suhu) itu menjadi energi serta juga sifat pendukungnya. Termodinamika tersebut berhubungan erat dengan fisika kerja, energi, panas, entropi dan juga juga kespontanan proses.
Selain dari hal tersebut, Termodinamika ini pun berkaitan dengan mekanika statik. Cabang ilmu Fisika ini adalah cabang ilmu yang mempelajari tentang pertukaran energi didalam bentuk kalor & kerja, sistem pembatas & lingkungan. Aplikasi serta juga penerapan Termodinamika ini bisa terjadi pada tubuh manusia, seperti pada kejadian di dalam pembangkit listrik ,perkakas elektronik, Refrigerator, meniup kopi panas, mobil, serta juga industri, hal tersebut merupakan kejadian dari Termodinamika yang paling sering kita ditemui kehidupan sehari-hari.
Prinsip Termodinamika
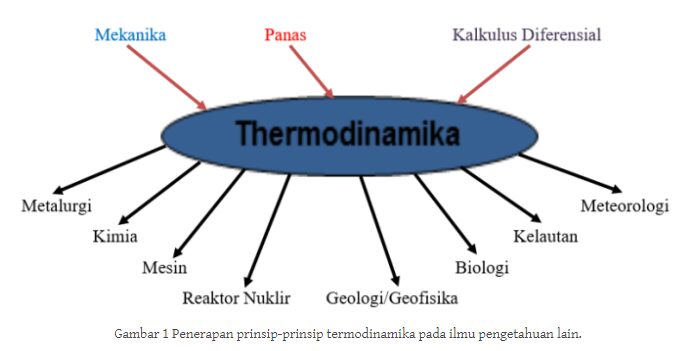
Di dalam penerapan prinsip-prinsip termodinamika yang kemudian meliputi Mekanika, Panas dan juga Kalkulus Diferensial di ilmu pengetahuan lain tersebut ditunjukkan pada Gambar ini .
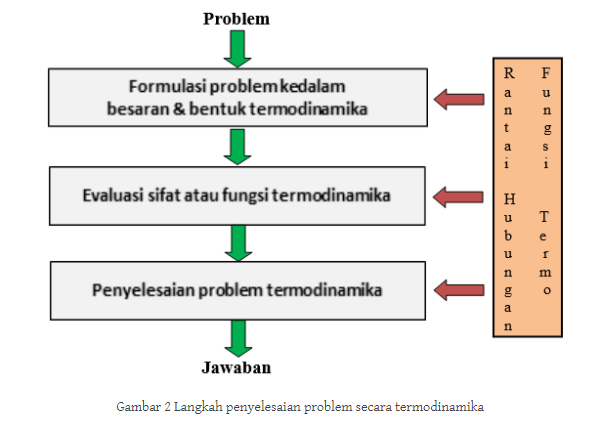
Gambar dibawah ini kemudian menunjukkan tentang penyelesaian pada masalah/problema dengan secara termodinamika itu dilakukan dengan melalui beberapa step atau tahapan, diantaranya ialah sebagai berikut :
- Pertama. Hal ini dikatakan dengan mengubah bahasa problem kedalam bahasa termodinamika, Baru setelah itu merumuskannya dengan memakai/menggunakan besaran termodinamika.
- Kedua, Hal ini kemudian memiliki arti di dalam melakukan analisis terhadap formulasi yang telah disusun pada langkah pertama (1). Tahap ini kemudian membutuhkan pemahaman tentang pengetahuan termodinamika yang memadai supaya tidak terjadi sebuah kesalahan persepsi terhadap arah maupun juga tujuan problema tersebut.
- Ketiga. Pada tahap ini selnajutnya dibutuhkan dukungan pengetahuan matematika/kalkulus (deferensial, integral) sehingga hal tersebut bisa atau dapat diperoleh jawaban yang valid atau pun bisa dipertanggungjawabkan.
Ketiga langkah termodinamika diatas, pun juga harus berpijak pada kaidah-kaidah atau pun juga dalil-dalil yang ada di dalam termodinamika.
Pada Intinya, prinsip termodinamika tersebut sebenarnya yakni hal alami yang terjadi di dalam kehidupan sehari-hari. Dengan semakin berkembangnya ilmu pengetahuan serta juga ilmu teknologi, termodinamika kini direkayasa sedemikian rupa sehingga sudah menjadi bentuk mekanisme yang tentu bisa membantu manusia di dalam aktivitasnya. Aplikasi termodinamika yang cakupannya begitu luas itu dimungkinkan disebabkan karna adanya perkembangan ilmu termodinamika yang dimulai sejak abad 17. Dipengembangan ilmu termodinamika tersevyt lalu dimulai dengan memakai pendekatan makroskopik yang merupakan perilaku umum dari partikel zat yang menjadi media pembawa energi.
Proses Termodinamika
Proses termodinamika ini lalu terbagi kedalam 4 macam, hal tersebut tergantung dari keadaan dari volume, tekanan, serta juga suhu disaat terjadinya proses itu. Proses tersebut pada dasarnya digambarkan di dalam sebuah diagram P-V, ini adalah diagram yang kemudian menggambarkan mengenai suatu tekanan (P) serta juga volume (V) di saat proses terjadi. Ada 2 hal perlu sekali untuk kemudian diingat bahwa dari segala jenis proses termodinamika, variabel yang berubah serta juga kemudian usaha yang dilakukan. Usaha yang kemudian terjadi didalam proses termodinamika itu bisa diketahui dengan menghitung luasan grafik P-V.
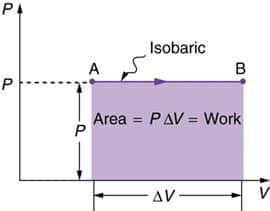
1. Proses Isobarik
Isobarik ini adalah proses termodinamika yang tidak mengubah nilai tekanan sistem ![]() . Nilai usaha itu bisa dihitung dengan persamaan berikut.
. Nilai usaha itu bisa dihitung dengan persamaan berikut.
![]()
Dari rumus tersebut, lalu diketahui juga bahwa apabila volume membesar (terjadi pemuaian) maka usaha nilainya adalah positif, serta juga apabila volume itu mengecil (terjadi penyusutan) maka usaha bernilai negatif.
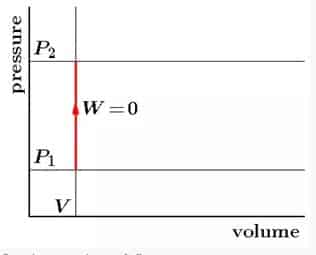
2. Proses Isokhorik
Isokhorik ini merupakan suatu proses termodinamika yang tidak mengubah nilai volume sistem ![]() . Didalam proses ini, nilai usaha itu 0 disebabkan oleh karna tidak ada luasan bangun yang ada didalam gambar P-V.
. Didalam proses ini, nilai usaha itu 0 disebabkan oleh karna tidak ada luasan bangun yang ada didalam gambar P-V.
3. Proses Isotermik
Isotermik ini ialah proses termodinamika yang tidak mengubah nilai suhu sistem ![]() .
.
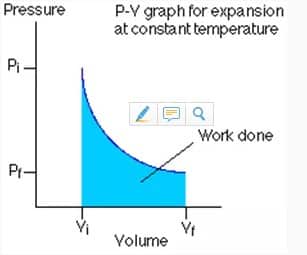
Nilai usaha diproses isotermik ini kemudian dinyatakan dengan persamaan berikut:
![]()
Yangmana
- n ini ialah jumlah zat yang dinyatakan yakni dengan satuan mol,
- R merupakan konstanta gas, serta untuk
- T ialah suhu.
Rumus itu kemudian didapatkan dengan cara menggabungkan persamaan usaha pada diagram P-V dengan persamaan gas ideal.
4. Proses Adibatik
Adiabatik ini ialah suatu proses termodinamika yang tidak mengubah nilai kalor sistem (Q = 0).
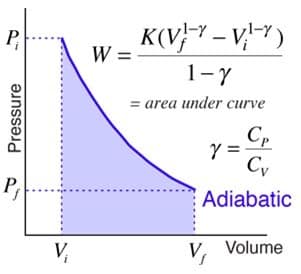
Pada gas monoatomic, usaha yang kemudian dilakukan diproses adiabatik itu bisa dinyatakan dengan persamaan:
![]()
Apabila diperhatikan, proses adiabatik dan juga isotermik ini memiliki diagram P-V yang serupa. Secara rinci, bisa dilihat bahwa proses adiabatik tersebut mempunyai kemiringan yang lebih curam jika dibandingkan dengan proses isotermik seperti contoh grafik dibawah ini.
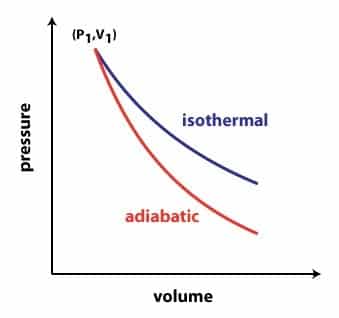
Apabila semua proses itu digambarkan yakni menjadi diagram P-V, maka dapat atau bisa didapatkan grafik berikut. Patut untuk kemudian diingat bahwa satuan-satuan yang digunakan di dalam perhitungan ialah Satuan Internasional. Sebagai contoh, satuan untuk suhu dipakai yakniKelvin, sedangkan untuk satuan volume yakni m3, serta untuk satuan jumlah zat itu yakni mol.
Siklus Termodinamika
Ilmu tentang siklus termodinamika penting di dalam sistem pembangkit tenaga. Mesin-mesin tersebut menggunakan campuran bahan baka r udara untuk operasinya.
Siklus termodinamika ini kemudian dapat diklasifikasikan secara umum, diantaranya sebagai berikut :
1. Siklus reversibel (bolak balik)
Siklus ini adalah sebuah siklus yang mana perubahan tersebut bisa atau dapat dibalikkan ke keadaan semula tanpa harus mengubah keadaan sekelilingnya. Di siklus ini seharusnya tidak ada kerugian panas disebabkan oleh gesekan, radiasi atau pun konduksi. Siklus ini kemudian akan reversibel apabila seluruh proses yang membentuk siklus juga reversibel.
2. Siklus irreversibel (tidak kembali)
Siklus ini adalah siklus tak terbalikkan. Di dalam mengembalikan ke keadaan semula itu kemudian harus mengubah keadaan sekelilingnya. Disiklus ini terdapat kerugian panas oleh karna gesekan, radiasi atau pun konduksi. Siklus ini juga terjadi apabila proses pembentukannya itu juga proses irreversibel.
3. Siklus Carnot
Siklus ini dibuat oleh Carnot seorang ilmuan yang pertama menganalisis permasalahan efesiensi mesin kalor. Pada mesin carnot, zat kerja di dalam melakukan operasi siklus yang terdiri dari 2 operasi termal serta dua operasi adiabatik. Mesin Carnot ini merupakan mesin kalor hipotesis yang beroperasi di dalam siklus reversibel.
Keadaan Termodinamika
Di waktu sistem di dalam keadaan seimbang dalam kondisi yang ditentukan, hal ini kemudian disebut dalam keadaan pasti (atau juga keadaan sistem).
Untuk keadaan termodinamika tertentu, banyak juga sifat dari sistem dispesifikasikan. Properti yang tidak tergantung dengan jalur sistem tersebut kemudian membentuk suatu keadaan yang dikenal dengan fungsi keadaan sistem. Bagian selanjutnya hanya mempertimbangkan mengenai properti, yang merupakan fungsi keadaan.
Jumlah dari properti minimal yang kemudian wajib/harus dispesifikasikan guna bisa menjelaskan mengenai/tentang keadaan dari sistem tertentu itu lalu ditentukan oleh Hukum fase Gibbs. Biasanya akan berhadapan dengan properti sistem yang juga lebih besar, dari jumlah minimal tersebut.
Pengembangan hubungan mengenai properti dari keadaan yang berlainan dimungkinkan. Persamaan keadaan ini merupakan contoh dari hubungan tersebut.
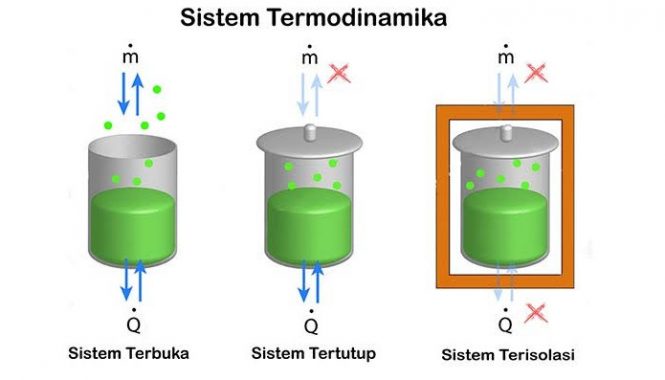
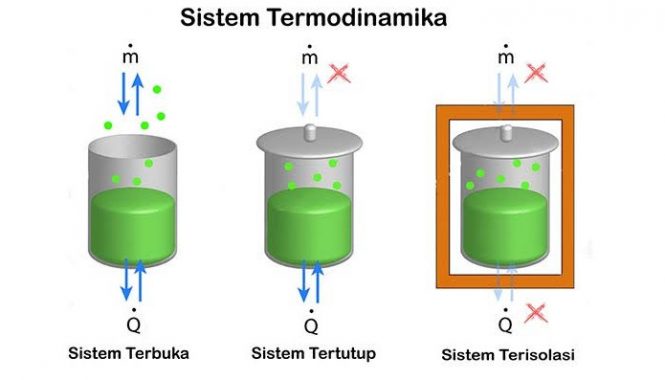
Sistem Termodinamika
Sistem termodinamika ini ialah bagian dari jagat raya yang kemudian diperhitungkan. Yang merupakan batasan yang nyata atau pun juga imajinasi yang memisahkan sistem dengan jagat raya, yang kemudian disebut dengan lingkungan. Klasifikasi sistem termodinamika yakni dengan berdasarkan sifat batas sistem-lingkungan dan juga perpindahan materi, kalor dan juga entropi antara sistem juga lingkungan.
Ada 3 jenis sistem dengan berdasarkan jenis pertukaran yang terjadi antara sistem dengan lingkungan:
Sistem tertutup
Terjadi pertukaran energi (panas serta kerja) tetapi tidak ada terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah salah satu dari contoh dari sistem tertutup yangmana didalamnya itu terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah sistem tersebut terjadi pertukaran panas, kerja dan keduanya itu biasanya kemudian akan dipertimbangkan sebagai sifat pembatasnya:
- Pembatas Adiabatik (tidak memperbolehkan pertukaran panas)
- Pembatas Rigid (tidak memperbolehkan pertukaran kerja).
Sistem terisolasi
Tidak terjadi pertukaran panas, benda maupun kerja dengan lingkungan. Contoh dari sistem terisolasi ini yakniwadah terisolasi, seperti misalnya termos dan tabung gas terisolasi.
Sistem terbuka
Terjadi pertukaran energi (panas juga kerja) serta benda dengan lingkungannya. Sebuah pembatas ini memperbolehkan pertukaran benda yang dikenal dengan istilah permeabel. Samudra ini adalah salah satu contoh dari sistem terbuka.
Hukum Dasar Termodinamika
Ada 4 Hukum Dasar yang berlaku pada sistem termodinamika, diantaranya ialah sebagai berikut :
Hukum Awal (Zeroth Law) Termodinamika
Hukum awal ini kemudian menggemukakan bahwa terdapat 2 sistem di dalam keadaan kesetimbang yakni dengan sistem ke-3, maka ke 3 nya itu saling setimbang antara yang satu dengan yang lainnya. Hukum ini kemudian dimasukkan setelah hukum pertama.
Hukum Pertama Termodinamika
Hukum ini juga berhubungan dengan kasus kekekalan energi. Hukum ini menggemukakan tentang/mengenai perubahan energi didalam sistem termodinamika tertutup, hal itu juga sama dengan total dari jumlah energi kalor yang disuplai ke dalam suatu sistem serta juga kerja yang dilakukan terhadap sistem tersebut. Hukum ini tentu bisa/dapat diuraikan menjadi beberapa proses, diantaranya ialah proses dengan Isotermik, Isokhorik, Isobarik terakhir adiabatik.
Hukum kedua Termodinamika
Hukum kedua termodinamika ini berhubungan dengan entropi. Tidak ada bunyi di dalam hukum ke-II termodinamika yang ada hanyalah 1 pernyataan mengenai kenyataan eksperimental yang kemudian dikeluarkan oleh kelvin-plank serta clausius.
- Pernyataan menurut clausius
tidak mungkin sistem apapun itu bekerja dengan sedemikian rupa sehingga hasil satu-satunya merupakan perpindahan energi yakni sebagai panas dari sistem dengan suhu/temperatur tertentu ke sistem yakni dengan temperatur yang lebih tinggi. - Pernyataan menurut kelvin-planck
bahwa tidak mungkin sistem itu kemudian beroperasi didalam siklus termodinamika dan juga memberikan beberapa netto kerja ke sekeliling sambil menerima energi panas dari 1 reservoir termal. (di dalam Fundamentals ofengineering thermodynamics (Moran J., Shapiro N.M.– 6th ed. – 2007–Wiley) Bab5).
Total entropi dari sistem termodinamika terisolasi tersebut kemudian cenderung untuk meningkat seiring dengan berjalannya waktu, setelah mendekati nilai maksimumnya. hal tersebut kemudian disebut juga dengan istilah prinsip kenaikan entropi” yang merupakan suatu korolari dari ke-II pernyataan yang ada diatas (analisis Hukum ke-II termodinamika untuk proses ialah dengan menggunakan sifat entropi) (sumber Fundamentals of engineeringthermodynamics (Moran J., Shapiro N.M. – 6th ed. – 2007 – Wiley) )Bab6).
Hukum ketiga Termodinamika
Hukum ketiga termodinamika ini ketiga ini berhubungan dengan temperatur nol absolut. Hukum ini lalu menggemukakan bahwa disaat sistem itu sudah mencapai temperatur nol absolut, maka semua prosesnya itu kemudian akan berhenti serta entropi sistem itu kemudian akan mendekati nilai minimum. Hukum ini juga menggemukakan bahwa entropi benda berstruktur kristal sempurna ditemperatur nol absolut bernilai nol.
Contoh Soal Termodinamika
Gas memiliki volume awal yakni 10 m3 dipanaskan dengan keadaan isobaris sampai pada di volume akhirnya itu menjadi 25 m3. Apabila tekanan gas itu yakni 2 atm, maka tentukan usaha luar gasnya ? (1 atm = 1,01 x 105 Pa).
Jawab:
Diketahui bahwa:
V2 = 25 m3
V1 = 10 m3
P = 2 atm = 2,02×105 Pa
Yang Ditanyakan adalah W?
Isobaris → Tekanan Tetap, pakai rumus W = P (ΔV)
W = P(V2 −V1)
W = 2,02x 05 x(25 − 10)= 3,03×106 joule
Demikianlah penjelasan mengenai Pengertian Termodinamika, Prinsip, Rumus, Hukum, Konsep dan Contoh, kami berharap apa yang diuraikan dapat bermanfaat untuk anda. Terima kasih